がんと戦うT細胞免疫の活性化と、
根本的な制御システムを明らかにする
もと、慶應義塾大学医学部吉村研 ちくまのページ
研究内容
時間があるときにちょびちょび更新していきます。
(1)がんや病原体との闘いに必要な、T細胞活性化のアクセルとブレーキ(免疫チェックポイント)を知る
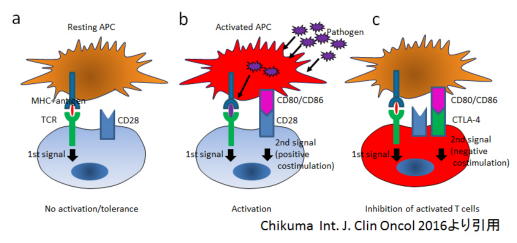
T細胞の活性化は、
1)抗原認識
2)アクセル
3)ブレーキ
によって調節されている。
代表的な「アクセル」は、CD28レセプターで、T細胞の活性化に必須。一方、CTLA-4レセプターは、T細胞が活性化しないように、「ブレーキ」の役割を果たす。
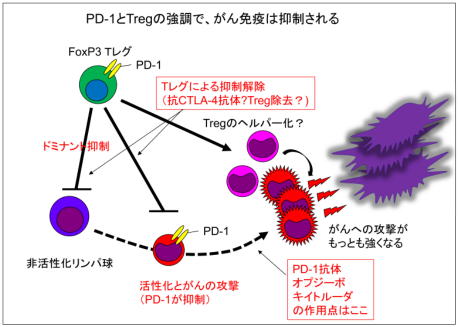
と、よく上のような図を使って説明されており、私も授業などではこう教えるのだが、これは本当でしょうか。(いきなり自分否定)
たとえば、CD28欠損マウスでは、免疫反応が起こらないばかりか、CD28を必要とするTregが欠損していろいろな局面で自己免疫疾患が起こったり、酷くなったりします。
がんで脚光を浴びているPD-1についてはどうでしょうか。
PD-1抗体(ペムブロリズマブ:商品名キイトルーダ、ニボルマブ:商品名オプジーボ)は、下図のように、がんと直接戦う「キラーT細胞」が、「疲れてくる(ブレーキがかかりすぎる)」ところのカンフル剤「ブレーキ抑制剤」として働いていると言われていますが、本当でしょうか。
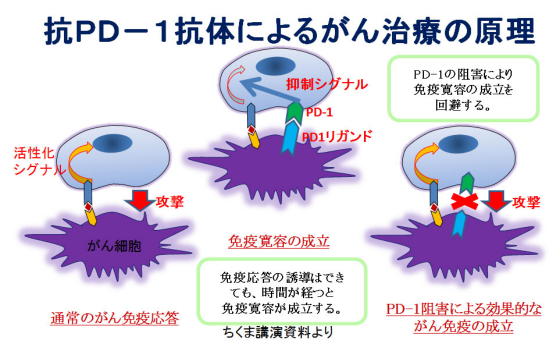
たとえば、完全に「疲弊」したT細胞は、PD-1抗体によって「若返る」ことはなく、疲弊したと考えられる集団のなかにいる、「まだ戦える集団」が再活性化されるという報告があります。(Im et al. Nature 537 417-421, 2016)
そのへんの、「わりと常識として信じられていること」を、もうすこしきっちりと理解できることを目指して研究を進めています。
これまで、明らかにした事。
1.「PD-1は、T細胞の不応答性に重要」
PD-1 ノックアウトマウスは、長期間飼育することによってヒトに見られるような自己免疫疾患を発症する(Nishimura Science 2001 Nishimura Immunity 1998など)。 しかしながら、一般に自己免疫疾患は、長い年月を経て徐々に起こる病気なので、いつ、どのような免疫細胞が、何をきっかけに活性化し、自己免疫の引き金になるのかという病因を探るには、個々の免疫細胞に特化した解析をする必要がある。
2006年に本庶研へリクルートされた際、当時の上司であった岡崎さんがPD-1を欠損した「モノクローナルマウス(正確には、2C TCR Tg, Rag2 KO PD-1 KO)」を作り出してくれていた。モノクローナルマウスでは、理論上体内の、すべてのT細胞がナイーブに保たれ、外来のSIYRYYGLぺプチドを投与するとこれを認識し、免疫反応を開始する。このマウスの免疫反応を、PD−1を正常に発現できるコントロールマウス(2C TCR Tg, Rag2 KO PD-1 KO)と比較すると、特定の抗原に対するT細胞の反応を、個体レベルで調べることが出来る。
コントロールマウスに、SIYRYYGLぺプチドを投与し、1週間後に回収した、「いちど抗原に反応したT細胞」を回収し、もう一度同じペプチドで刺激すると、ほとんど反応しなくなる。つまり、炎症反応なしに抗原認識したT細胞が陥る、不応答(アナジー)の条件を再現できた。一方、同じ条件で、PD-1を欠損したマウスモノクローナルマウスのT細胞は、ほとんど不応答にならなかった。
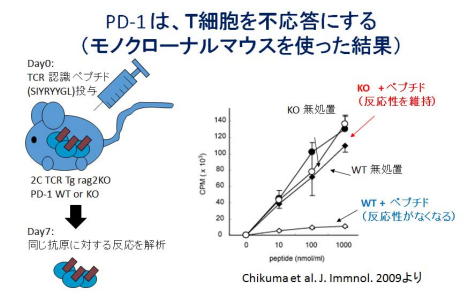
このことは、他のT細胞が存在しない状況ではPD-1がドミナントな役割を果たす事を示している。また、他のグループから、CTLA-4を欠損したモノクローナルマウス(2CTCR Tg, Rag2 KO CTLA4 KO)は報告されているが、このマウスではCD8細胞のレスポンスは、ほとんど普通のマウスに遜色ない。
ちゃんと不応答になるコントロールマウスでは、PD−1の発現は、抗原刺激後わずか6時間で観察された。これらのことから、PD−1は、より早期に誘導され、不応答性の獲得に大きく貢献することがわかる。1stシグナルだけでおこると信じられてきたT細胞の不応答性(アナジー)は、実はPD−1が誘導され、T細胞を抑制することで起こることが明らかになった。
2.「PD−1阻害は、制御性T細胞が働きにくい状況でもっとも高い効果を発揮する。」
自己反応性のT細胞が、すべて不応答にならなければ生まれてすぐに自己免疫疾患が発症するはず。しかし、通常のPD-1ノックアウトマウス(PD-1 KO)は、長い時間をかけて徐々に自己免疫になる。
健康な体には、自己反応性T細胞の活性化を抑制する、制御性T細胞(regulatory Tcell: Treg)という細胞が存在し、これがPD-1 KOの体内に存在する、自己反応性T細胞を抑えつけているのかも知れない。PD-1 KOの中で、Tregがどのように振舞うのかを研究しやすくするため、Tregが緑色に光るマウス(FoxP3-IRES GFPCRE)に、PD-1 KOを交配した。 不思議なことに、生まれてきたマウス(PD-1 KO FoxP3-IRES GFPCRE)は、生後2〜3週間で)なぜか死に始め、2ヶ月程度で全マウスが死んでしまった。解剖してみると、すい臓にT細胞性炎症が起こり、この、自己免疫性すい炎(すい臓がほとんど溶けてしまう)によって、マウスが死亡することがわかった。
原因を調べていくと、Tregのレポーターとして使おうと思ったFoxP3-IRES GFPCREマウスでは、緑色蛍光タンパクを無理やり、Tregの機能遺伝子であるFoxP3遺伝子につないだため(ノックインマウス)、FoxP3遺伝子自体の発現が通常の2割くらい、弱くなっていることがわかった。
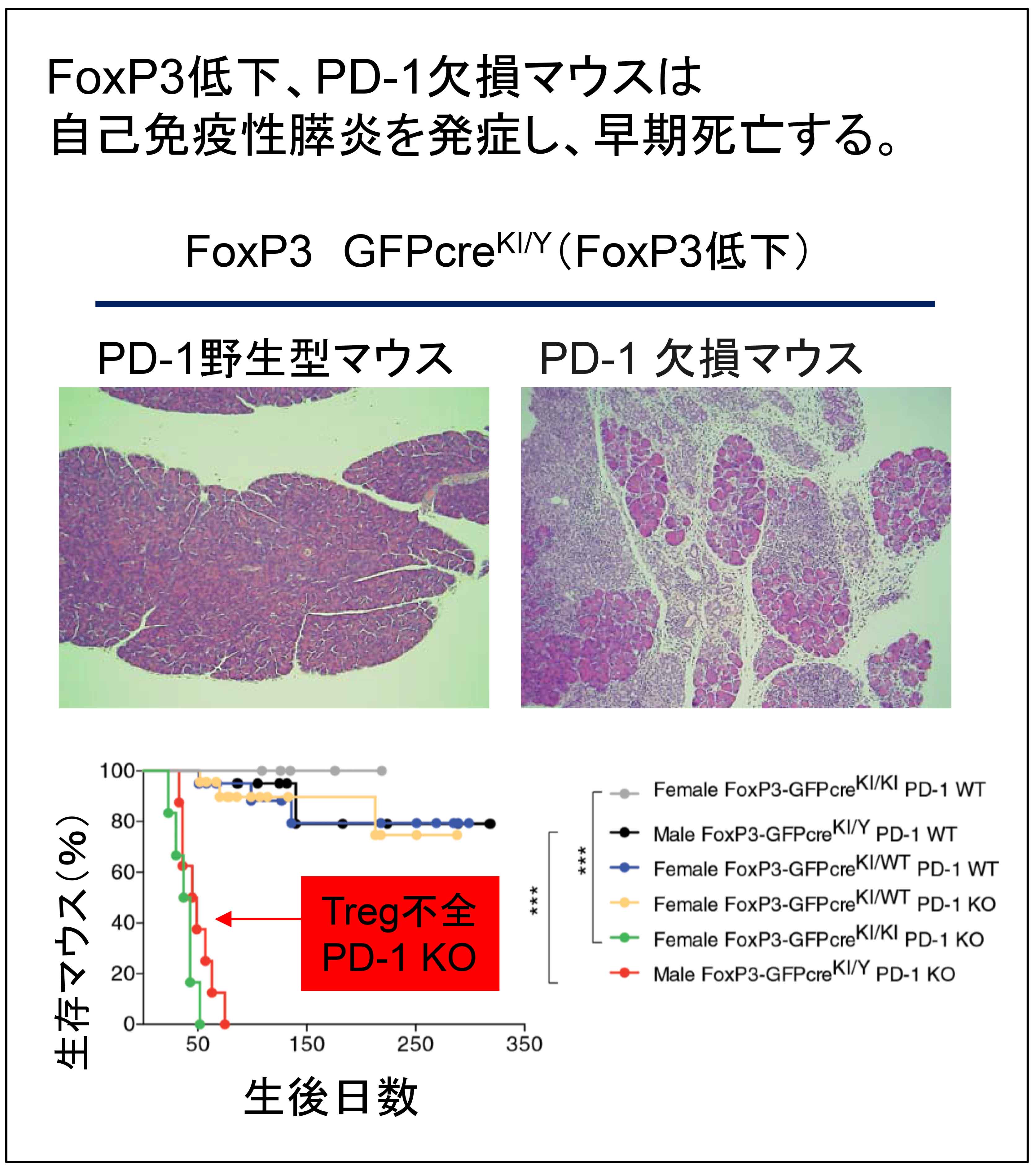
Zhang*, Chikuma* et al. (equal contributuin) PNAS, 2016より
FoxP3-IRES GFPCREマウスやPD-1 KOマウスは、それぞれFoxP3やPD-1の不全はあるものの、すい炎を発症しない。つまり、実験上システムが人工的だった(artifact)から見つかった偶然ではあるが、Tregがほんの少しでも弱った状況では、PD-1が自己反応性T細胞を抑える活性は、非常に重要ということになる。
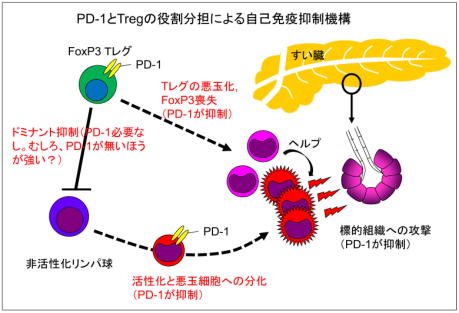
がん免疫治療のように、「がん反応性T細胞」に良く働いてほしい状況では、PD-1抗体のみでは不十分で、Tregによるドミナント抑制(無理やり抑えつけている状況)をある程度弱らせてやることが重要といえる。現在PD-1抗体は、20%〜30%の患者さんに効くが、Tregのコントロールが出来ればその奏効率は格段にアップするだろう。
(Nr4a阻害剤とか? Hibino, Chikuma et al.Cancer Research, 2018)
(副作用に関する研究についてはまた次回)